Kimyasal Tepkimeler 8. Sınıf

Kimyasal değişimler sonucunda yeni özellikte maddeler oluştuğunu keşfettiniz mi! Gaz çıkışı, ısı ve ışık yayılımı, renk değişimi kimyasal değişimin olduğunun göstergesidir. Demirin paslanması, etin pişmesi, mumun yanması gibi olayların kimyasal değişmelere örnektir.
Kimyasal değişmeler sırasında kimyasal bağlar kopar ve yeni bağlar oluşur. Kimyasal olaylar, maddelerin birbirleriyle etkileşmesi sonucu oluşabileceği gibi ısı ve dış etkilerle de oluşabilir. Örneğin demirin paslanması olayında demir havadaki oksijenle reaksiyona girerek pası oluştururken, suyun kendisini oluşturan bileşenlerine parçalanması olayı suyun elektrik akımıyla elektrolizi sonucu ortaya çıkar.
Kimyasal tepkimeler sırasında değişim geçiren maddelere reaksiyona girenler, yeni oluşan maddelere de reaksiyondan çıkanlar ya da ürünler denir. Demirin paslanması sırasında havadaki oksijenle demir birleşerek demir oksit denilen pası oluşturur. Burada demir ve oksijen tepkimeye girenler, demir oksit ise tepkimeden çıkan üründür.
Kimyasal tepkimeler sırasında meydana gelen değişiklikler, kimyasal denklemlerle gösterilir. Kimyasal denklemlerde reaksiyona giren maddeler ile çıkan maddeler formüllerle gösterilir. Örneğin kömür yanarken içindeki karbon havadaki oksijenle birleşir ve karbon dioksit açığa çıkar.
| Girenler | Çıkanlar (Ürün) |
|---|---|
| C + O2 ————> | CO2 |
| Kömür + Oksijen | Karbondioksit |
Yukarıdaki denklemden de görüldüğü gibi tepkimeye giren maddeler arasına “+” işareti konulurken, tepkimeye giren ve çıkan maddeler arasına ise “ok” konulmaktadır. Giren maddeler her zaman okun solunda, tepkimeden çıkan maddeler (ürünler) ise okun sağında bulunur.
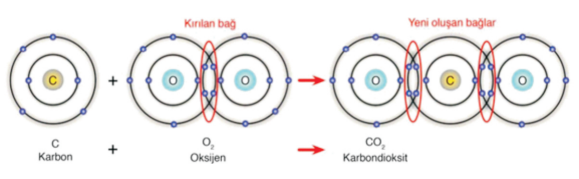
Kimyasal denklemler, tepkime hakkında birçok bilgiyi basit bir şekilde göstermemize ve anlamamıza yardımcı olurlar. Örneğin yukarıdaki gösterimle; tepkime giren bir karbon atomu ile iki oksijen atomunun birleşmesiyle, bir karbon ve iki oksijen atomundan oluşan bir karbondioksit molekülünün meydana geldiğini rahatlıkla anlayabiliyoruz. Bu durumda kimyasal tepkimeler gerçekleşirken atom sayısı ve türü korunur diyebiliriz ancak oksijen molekülündeki (O2) bağların kopmasıyla ve karbon ile oksijenler arasında yeni bağların oluşup karbon dioksit (CO2) molekülünün açığa çıkmasıyla anlaşılan kimyasal tepkimeler gerçekleşirken molekül sayısı ve türü korunmayabilir.
Kimyasal tepkimelerde oluşan yeni madde, kendisini oluşturan maddelerden tamamen farklı fiziksel ve kimyasal özelliklere sahiptir.
Aşağıda su molekülünün oluşumu ile ilgili kimyasal tepkime şema olarak gösterilmiştir. Birlikte inceleyelim:
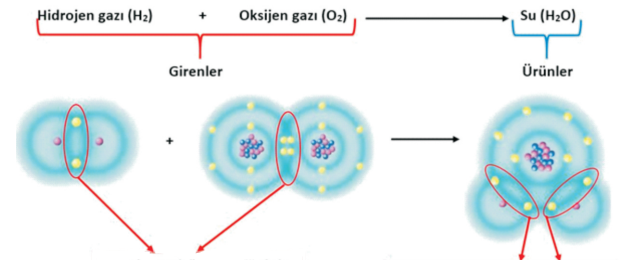
| Hidrojen ve Oksijen moleküllerinde yer alan kovalent bağlar kırılır (kopar). | Hidrojen ve Oksijen molekülleri arasında yeni kovalent bağlar oluşur ve yeni bir madde olan su meydana gelir. |
Oluşan su molekülü, yanıcı özelliğe sahip olan hidrojen gazı (H2) ile yanma olayını destekleyen oksijen molekülünün (O2) reaksiyona girmesi ile oluşmaktadır. Suyun özelliklerini göz önünde bulundurduğunuzda kimyasal tepkime süresince hidrojen ve oksijen gazlarının tamamen kendi özelliklerini kaybetmiş olduğunun farkına edebilirsiniz. Oksijen ve hidrojenin suyu oluşturmasında olduğu gibi maddenin kimlik değiştirmesine neden olan kimyasal tepkimeler aynı zamanda atomlar arası bağların kopması ve yeni bağların oluşması olayıdır.
Kimyasal tepkimelerde atomlar yok olmadığı ve yeni atomlar oluşmadığı için tepkimeden sonra yeni madde oluştuğunda kütlede herhangi bir değişiklik olmaz. Diğer bir ifadeyle kimyasal tepkimelerde tepkimeye giren madde miktarı ile tepkime sonucu oluşan madde miktarı birbirine eşittir. Dolayısıyla kütle korunur.
Su molekülü oluşurken hidrojen ve oksijen moleküllerinin kendi arasındaki bağlar kırılır, oksijen ve hidrojen atomları arasında yeni bağlar oluşur. Kimyasal tepkimelerde reaktif maddelerdeki (reaksiyona giren maddeler) atom sayıları ile ürün kısmında oluşan maddelerdeki atom sayılarının eşit olması gerektiğini öğrenmiştik. Sayıları eşit değilse her iki taraftaki atom sayıları eşitlenmelidir. Bu eşitlenmeye denklemin denkleştirilmesi denir.
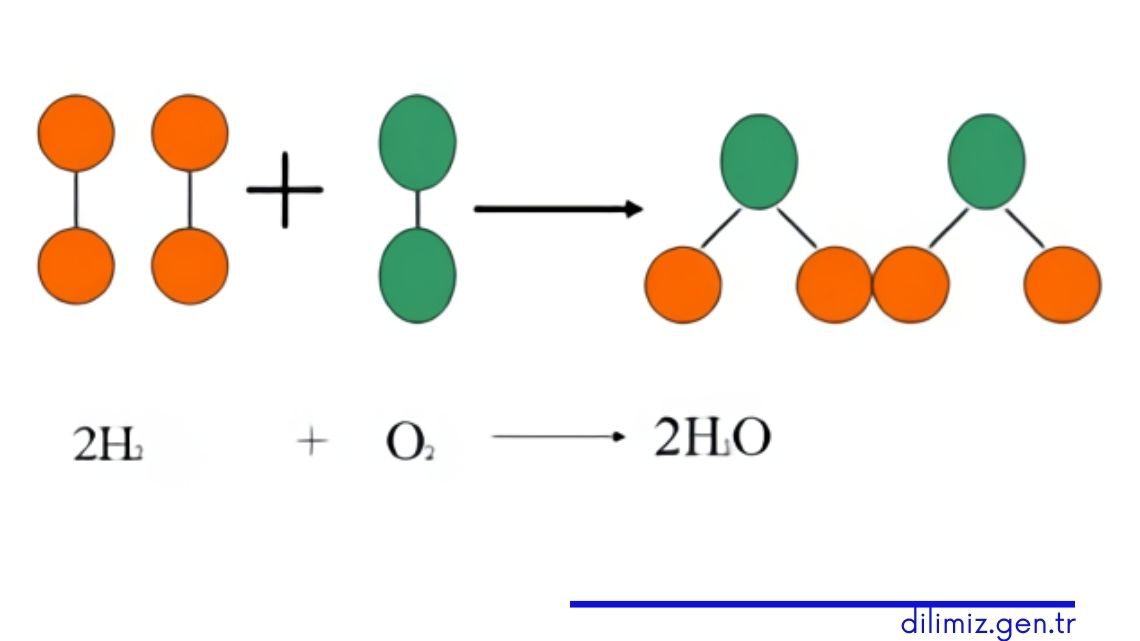
Yukarıda verilen su oluşumu tepkimesinden de görebileceğiniz gibi moleküllerin önüne katsayılar eklenerek denklemler denkleştirilir. Molekülün önündeki katsayılar, atomları çarpım olarak etkiler. Kimyasal tepkimelerin denkleştirilmesi için sırayla aşağıdaki adımlar izlenmelidir.
Kimyasal tepkimelerin denkleştirilmesi
Adım 1: En fazla sayıda atom içeren molekülün başına “1” yazılır.
C3H4 + O2 ———-> CO2 + H2O
Atom sayısı en çok olan bileşik C3H4‘tür. Bu bileşiğin kat sayısını “1” alalım ve sağ ve sol taraftaki atom sayılarını birlikte sayalım.
1 C3H4 + O2 CO2 + H2O
Sol tarafta 3 tane karbon, 4 tane H atomu vardır. Sağ tarafta da 3 tane karbon, 4 tane hidrojen atomu olmalıdır. Sağ tarafta 1 tane karbon atomu olduğuna göre, CO2‘nin önüne “3” eklenerek karbon sayısı 3’e eşitlenir. Sağ tarafta iki Hidrojen atomu olduğuna göre, H2O’nun önüne “2” eklenerek hidrojen atom sayısı 4’e eşitlenir.
1 C3H4 + O2 ———-> 3 CO2 + 2 H2O
Adım 2: Hidrojen ve oksijen elementleri en sonda denkleştirilmelidir.
6 oksijen atomu CO2‘den, 4 oksijen atomu da H2O’dan gelmektedir. Bu durumda sağ tarafta toplam 8 oksijen atomu varken, sol tarafta 2 oksijen atomu bulunmaktadır. Oksijen atomlarını eşitlemek için O2‘nin önüne 4 getirilir.
1 C3H4 + 4 O2 ——> 3 CO2 + 2 H2O
Adım 3: Element molekülleri hariç hiçbir molekülün başına rasyonel (kesirli sayı) yazılamaz.
Kimyasal bir bileşiğin oksijenle tepkimeye girmesi sonucu yanma tepkimeleri (reaksiyonları) meydana gelir. Aşağıda yanma tepkimeleri ile ilgili verilen örnekleri inceleyiniz.
- C3H8 + 5 O2 ——-> 3 CO2 + 4 H2O
- 2 C2H5OH + 7 O2 —–> 4 CO2 + 6 H2O
- C + O2 —–> CO2
- 2 Mg + O2 —–> MgO
Yukarıdaki örneklerde de olduğu gibi yapısında karbon ve hidrojen bulunduran organik maddeler yandıklarında karbondioksit ve su oluşur. Yanma tepkimeleri kimyasal bir olaydır. Maddenin yapısını değiştirir. Yanma olayları sonucunda ısı açığa çıkar.