Kimyasal bağlar ve özellikleri nelerdir?
Kimyasal Bağlar
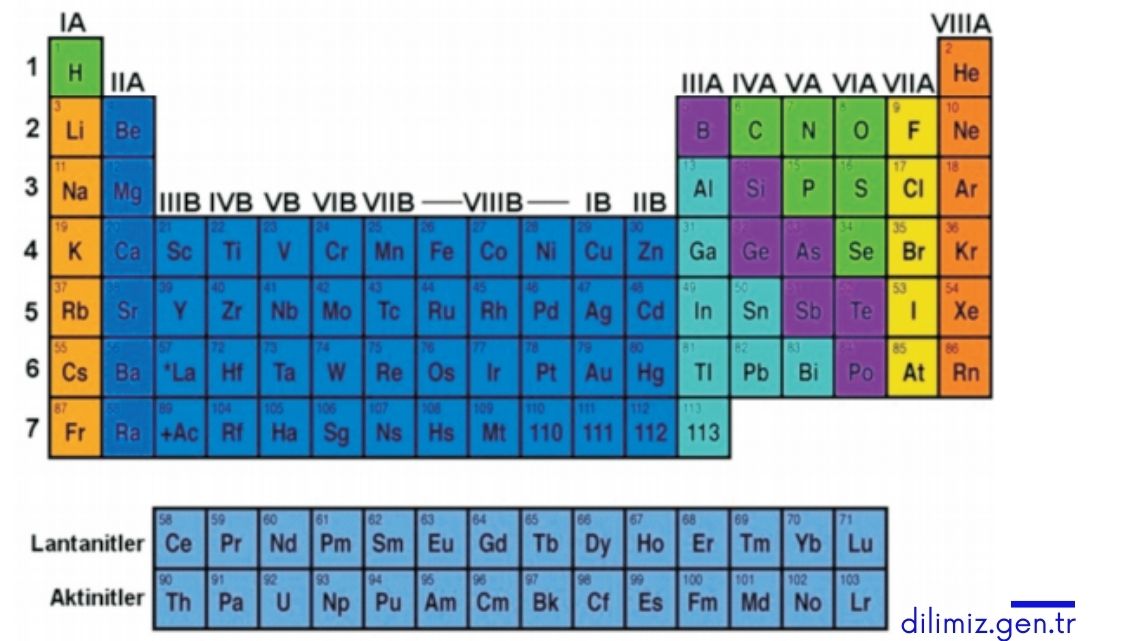
Periyodik tablodaki atomlar; elektron vererek, alarak ya da elektronlarını ortaklaşa kullanarak dublet ve oktet kurallarına uygun olarak kararlı hale geçerler. Peki, hangi atomların elektron alacağına ya da elektron vereceğine ve hangi atomların elektronlarını ortaklaşa kullanarak kararlı hale geçeceğine nasıl karar vereceğiz?
Metaller (en dış katmanlarında bir, iki, üç elektron bulunduran atomlar) elektron vererek, ametaller (en dış katmanlarında beş, altı ve yedi elektron bulunduran atomlar) ise elektron alarak elektron dizilim düzenlerini soy gazların elektron dizilimi düzenine benzetmeye çalıştıklarını öğrenmiştik. Başka bir ifadeyle metaller elektron vermeye, ametaller ise elektron almaya yatkın olduklarından elektron alış verişi sonucunda iyonlar arasında kimyasal bağ oluşur.
İyonik Bağlı Bileşiklerin Formüllerinin Yazılması
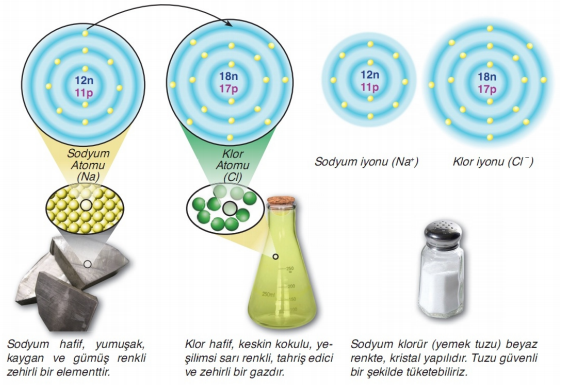
- Sodyum atomunun elektron dizilimi 11Na: 2 8 1
- Klor atomunun elektron dizilimi ise 17Cl: 2 8 7 şeklindedir.
Bu durumda sodyum, en son katmanında bir elektron taşıdığından onu vererek soy gaza benzemek ister. Klor atomu da son elektron katmanında yedi elektron taşıdığından bir elektron daha alıp son katmanındaki elektron sayısını sekize tamamlamak eğilimindedir. Böylece sodyum bir elektron vererek 1+ değerlikli katyona, klor ise bir elektron alarak 1- değerlikli anyona dönüşür. Metaller ve ametaller arasında elektron alış verişi sonucu oluşan kimyasal bağa İyonik Bağ adı verilir. Sodyum ve klor arasında oluşan bağ sonucu sodyum klorür bileşiği meydana gelir.
İyonik bileşikleri oluşturan atomlarda meydana gelen elektron alış-verişinden dolayı elektron veren atoma katyon (+ yüklü), elektron alan atoma anyon (– yüklü) denildiğini öğrenmiştik.
İyonik bileşiğin formülü yazılırken:
- İlk önce katyon daha sonra anyon yazılır.
- Katyonun yükü anyonun altına, anyonun yükü de katyonun altına gelecek şekilde çaprazlama yapılır. Böylece bileşikteki toplam yük sıfır olur. Çaprazlama yapılırken yüklerin işareti dikkate alınmaz.
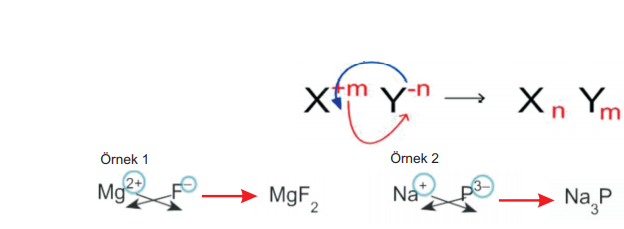
3. İyonik yapılı bileşikler en sade şekli ile yazılır.
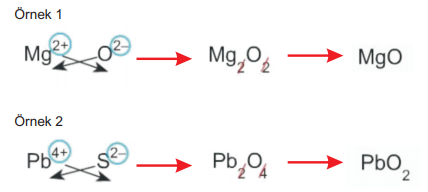
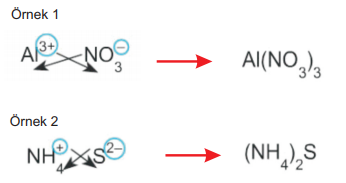
4. Katyon ya da anyon çok atomlu ise bileşik yazılırken çok atomlu iyonun altına sayı gelecekse paranteze alınmalıdır.
Aşağıdaki tabloda sıkça kullanılan önemli katyonları bulunmaktadır.
Sıkça kullanılan katyonlar arasında parantez içerisinde romen rakamı ile belirtilmiş sayıları görüyorsunuz. Birden fazla değerlik alan katyonlar, bileşiklerinde hangi değerliği almışlarsa parantez içerisinde romen rakamı ile belirtilmelidir.
| +1 Yüklü | +2 Yüklü | +3 Yüklü | +4 Yüklü |
|---|---|---|---|
| Li+1 Lityum | Be+2 Berilyum | AI+3 Aleminyum | Sn+4 Kalay (IV) |
| Na+1 Sodyum | Mg+2 Magnezyum | Fe+3 Demir (III) | Bp+4 Kurşun (IV) |
| K+1 Potasyum | Ba+2 Baryum | Cr+3 Krom (III) | |
| Rb+1 Rubityum | Zn+2 Çinko | ||
| Cs+1 Sezyum | Cu+2 Bakır (II) | ||
| Ag+1 Gümüş | Hg+2 Cıva (II) | ||
| Cu+1 Bakır | Fe+2 Demir (II) | ||
| Hg+1 Cıva | Cr+2 Krom (II) | ||
| NH+1 Amonyum | Pb+2 Kurşun (II) |
Aşağıdaki tabloda ise sıkça kullanılan önemli anyonlar yer almaktadır.
| 1- Yüklü İyonlar | 2-, 3- Yüklü İyonlar |
|---|---|
| H– Hidrür | O2- Oksit |
| F– Florür | S2- Sülfür |
| CI– Klorür | N2- Nitrür |
| Br– Bromür | P2- Fostür |
| I– İyodür |
İki veya daha fazla atomdan oluşan iyonlara çok atomlu iyonlar denildiğini öğrenmiştik. Aşağıdaki tabloda sıkça kullanılan çok atomlu iyonlar verilmektedir. Çok atomlu iyonlara ait yanda verilen tablodan da gözlemleyebildiğimiz gibi çok atomlu iyon olarak “+” yüklü olarak sadece amonyum iyonu (NH) bulunmaktadır.
| İyonun Adı | İyonun Formülü |
|---|---|
| Fosfat | PO43- |
| Karbonat | CO32- |
| Nitrat | NO3– |
| Sülfat | SO42- |
| Hidroksit | OH– |
| Amonyum | NH4+ |
İyonik Bağlı Bileşiklerin Adlandırılması
İyonik bileşikler adlandırılırken;
1- Metalin (katyonun) adı + ametalin (anyonun) adı + “ür” eki
Katyonların okunuşu elementin okunuşuyla aynıdır; ancak anyonlar okunurken elementin adının sonuna “ür” eki getirilir.
- NaF: Sodyum florür
- AlCl3: Aluminyum klorür
Anyonlar isimlendirilirken “ür” ekini alırken, Oksijen diğer anyonlardan farklı olarak “oksit” ismini almaktadır.
- MgO: Magnezyum oksit
2- Metalin adı + çok atomlu anyonun adı
- K2CO3: Potasyum karbonat
- MgSO3: Magnezyum sülfat
3- Çok atomlu katyonun adı + çok atomlu anyonun adı
- NH4NO3: Amonyum nitrat
- (NH4)2SO4: Amonyum sülfat
4- Çok atomlu katyonun adı + ametalin adı + “ür” eki
- NH4F: Amonyum florür
- (NH4)2S: Amonyum sülfür
5- Sıkça kullanılan katyonlar tablosundan da gözlemlediğiniz gibi katyon birden fazla değer alabiliyorsa isimlendirme esnasında katyonun değerliği adının yanına parantez içerisinde romen rakamlarıyla yazılır.
- FeO: Demir (II) oksit
- Fe2O3: Demir (III) oksit
- FeCl3: Demir (III) klorür
- CuS: Bakır (II) sülfür
- Cu2S: Bakır (I) sülfür
Her iki atom da elektron almaya yatkın olduklarından aralarında elektron ortaklaşması ile kimyasal bağ oluşur. Ametal atomları arasında elektronların ortaklaşa kullanılması sonucunda oluşan bağlara Kovalent Bağ adı verilir.
Kovalent bağlı bileşiklerin en küçük birimi moleküldür. Moleküller, maddenin tüm özelliklerini gösterir. Aynı cins atomlardan oluşan moleküller element molekülleridir. H2, O2, N2, F2, Cl2 element moleküllerinden bazılarıdır.
Farklı cins atomların molekülleri ise bileşik molekülleridir. H2O, CO2, NH3 bileşik moleküllerinden bazılarıdır. Örneğin karbon dioksit (CO2) karbon ve oksijen atomlarından oluşmaktadır.
- Karbonun elektron dizilimi : 6C: 2 4
- Oksijenin elektron dizilimi : 8O: 2 6 şeklindedir.
Karbon ve oksijen elektronlarını ortaklaşa kullanarak kararlı hale geçerler. CO2 kimyasal formülünden de anlaşılacağı üzere bir karbon, iki oksijen ile elektron ortaklaşması yaparak her biri en son yörüngesindeki elektron sayılarını 8’e tamamlar ve kararlı hale geçer.